İyodat IO3- İyonunun Lewis Yapısı ion lewis structure
Makale: Lewis Nokta Yapısı Structure
- 1.Lewis Elektron Nokta Yapısı Nasıl Bulunur?
- 2.Formal Yük Nasıl Hesaplanır?
- 3.Lewis Nokta Yapısı NO, NO2, NO3
- 4.İyodat IO3- İyonunun Lewis Yapısı ion lewis structure
- 5.Lewis Nokta Yapısı HCN
- 6.Lewis Nokta Yapısı CO (Karbonmonoksit)
- 7.Lewis Nokta Yapısı CO2 (Karbondioksit)
- 8.Lewis Nokta Yapısı CO3 2- (Karbonat)
İyodat IO3- İyonunun Lewis Yapısı nı göstermeden önce şunu bilmeliyiz ki bir iyonun veya molekülün lewis yapısı çizilirken dikkat edilmesi gereken adımlar vardır. Fakat bu adımlar çizilecek yapıya göre karmaşık bir hal alabilir. Genel olarak aşağıdaki şekilde ifade edilebilir:
- Toplam değerlik elektron sayısı (des) hesaplanır.
- Merkez atom seçimine karar verilir.
- Merkez atomun etrafına atomlar ve yalın çiftler yerleştirilir.
- Elektronlar dağıtılır ve atomların formal yüklerine bakılır.
- En iyi lewis yapısını elde etmek için yalın çiftleri bağlara dönüştürerek kararlılık kontrol edilir ve atomlar üzerindeki yükler en aza indirilir.
- Rezonans yapılar oluşturulur.
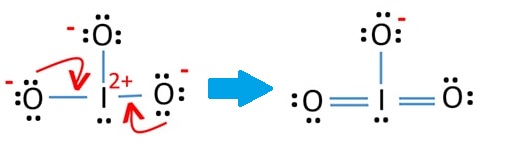
(IO3-) İyonunun Lewis Yapısı
- Toplam des: 7+6×3+1 = 26 elektron
- İyot, oksijenden daha yüksek değerlik alır. I’nın merkez atom olması daha uygundur.
- FY(iyot)=7-(2+6/2)=+2
FY(oksijenler)=6-(6+2/2)=-1 - İyot değerlik kabuğundaki orbitallerini kullanarak oksijenlerden birer yalın çift alarak iki tane pi bağı yapabilir.
- Bu şekilde iyotun formal yükü sıfır olur. Pi bağı yapan oksijenlerin formal yükü sıfır olur. Geriye kalan oksijenin formal yükü -1 olur. Daha kararlı bir yapı elde edilir.

(IO3-) iyonu sp3 hibritleşmesi yapmıştır.
VSEPR: AX3E, Elektron çifti geometrisi tetrahedral (düzgün dört yüzlü), molekül geometrisi üçgen piramit
(IO3-) iyodat olarak okunur.
Ayrıca iyodatın Molar kütlesi 174,903 g/mol’dür. İyodat periyodatın thioether ile indirgenmesi sonucunda elde edilebilir. Bazı bileşikleri NaIO3 (Sodyum İyodat), KIO3 (Potasyum İyodat), AgIO3 (Gümüş İyodat)
Nokta kimya youtube kanalımızdan haberiniz var mı?
